Химическое лужение. Часть 2
Добрый день, уважаемые радиолюбители.
Прошло уже чуть больше года, как я начал экспериментировать с составами химического лужения. За прошедшее время к исходной статье появились некоторые замечания, дополнения, предложения, а так же обобщающие выводы. Именно об этом мы и поговорим в данной части статьи [1].
Но прежде чем начать, рассмотрим ещё один важный процесс, актуальный для радиолюбителей — химическое серебрение [2-4].
Химическое серебрение — это процесс, основанный на осаждении серебра из растворов его комплексных солей без применения электрического тока. Химическое серебрение относится к иммерсионным процессам.
Химическое серебрение в электронике может применяться для следующих целей:
- в качестве финишного покрытия печатных плат под пайку (т.к. серебро обладает высокой химической стойкостью: не окисляется кислородом воздуха даже при высоких температурах. Привычный многим тёмный налёт на серебре — это сульфид серебра. Он образуется во влажном воздухе в присутствии следов двухвалентной серы — сероводорода, тиосульфатов, резины и пр. Платы с подобным финишным покрытием в промышленных масштабах необходимо хранить в вакуумной упаковке с влагопоглотителем, а вскрывать непосредственно перед монтажом и пайкой);
- в качестве покрытия проводящего рисунка высокочастотных печатных плат (т.к. серебро обладает наименьшим электрическим сопротивлением среди металлов);
- в качестве покрытия проволоки высокочастотных катушек индуктивности для повышения их добротности (т.к. серебро обладает наименьшим электрическим сопротивлением среди металлов) [5, 6].
В качестве растворов химического серебрения рассмотрим 2 раствора [2-4].
Раствор №1:
- Нитрат серебра — 20…50 г/л;
- Лимонная кислота — 120 г/л;
- Тиомочевина — 100 г/л;
- Вода дистиллированная — до 1 л.
Раствор готовится следующим образом: в 0.8 литрах тёплой воды растворяется 100 грамм тиомочевины. После полного растворения тиомочевины в раствор добавляется 120 грамм лимонной кислоты и тщательно перемешивается до полного растворения. Для улучшения растворимости и ускорения растворения лимонной кислоты раствор можно подогреть на водяной бане до температуры 40-45 градусов Цельсия. После полного растворения лимонной кислоты необходимо добавить в раствор 20…50 грамм нитрата серебра. Нитрат серебра необходимо присыпать небольшими порциями, интенсивно и тщательно перемешивая раствор до полного растворения уже добавленного нитрата серебра. После этого необходимо добавить дистиллированной воды до 1 литра итогового раствора и тщательно его перемешать.
Готовый раствор прозрачен, имеет небольшой запах лимонной кислоты и серы. Хранить раствор необходимо в тёмном месте. Использовать можно многократно вплоть до полного истощения либо загрязнения раствора. Данный раствор пригоден для серебрения меди и её сплавов.
Подготовка поверхности перед химическим серебрением полностью аналогична подготовке поверхности перед химическим лужением [1].
Для химического серебрения необходимо в ёмкость подходящего размера и объёма налить раствор серебрения так, что бы слой над погружённой заготовкой составлял не менее 1 сантиметра, погрузить подготовленную (и обезжиренную) заготовку в раствор и, время от времени покачивая ёмкость для перемешивания раствора, выдержать 10-15 минут. За это время поверхность меди (сплава меди) равномерно покроется серебром.
После этого заготовку необходимо извлечь из раствора, тщательно промыть водой, ополоснуть 3% раствором щёлочи (но лучше порошковым чистящим средством типа Сорти/Пемолюкс, предварительно его увлажнив, но без фанатизма) при помощи губки (ХБ ткани) и тщательно смыть большим количеством воды остатки щёлочи (чистящего средства). После этого заготовку необходимо вытереть бумажной салфеткой либо ХБ тканью. На этом процесс химического серебрения можно считать оконченным.
В подборке фото ниже представлены результаты химического серебрения монеты номиналом 10 рублей. Монета изготовлена из стали с латунным гальванопокрытием [7].



По фото хорошо видно, что покрытие получилось равномерным, мелкие детали проработались хорошо, что подтверждает возможность использования данного состава для финишного покрытия печатных плат с небольшой шириной дорожек.
В подборке фото ниже представлены результаты химического серебрения заготовки из фольгированного стеклотекстолита размером около 6 на 5 сантиметров.



По фото хорошо видно, что на больших площадях покрытие так же получилось равномерным, без пятен и разводов. Это подтверждает возможность использования данного состава для химического серебрения печатных плат.
Раствор №2:
- Нитрат серебра — 20…50 г/л;
- Тиомочевина — 70 г/л;
- Серная кислота — 120 мл. 30% раствора;
- Гидроксид натрия — 6 г/л;
- Вода дистиллированная — до 1 л.
Раствор готовится следующим образом: в 0.7 литрах тёплой воды растворяется 70 грамм тиомочевины. После полного растворения тиомочевины в раствор добавляется 6 грамм гидроксида натрия. Гидроксид натрия необходимо присыпать понемногу, тщательно и интенсивно перемешивая раствор. После полного растворения гидроксида натрия к раствору приливается 120 мл. 30% раствора серной кислоты и тщательно перемешивается. Далее в раствор добавляется 20…50 грамм нитрата серебра. Нитрат серебра так же добавляется небольшими порциями, а раствор при этом интенсивно и тщательно перемешивается вплоть до полного растворения добавленной порции. После этого необходимо добавить в раствор дистиллированной воды до 1 литра итогового раствора и тщательно его перемешать.
Готовый раствор прозрачен, имеет небольшой запах серы. Хранить раствор необходимо в тёмном месте. Использовать можно многократно вплоть до полного истощения либо загрязнения раствора. Данный раствор пригоден для серебрения меди и её сплавов.
Способ применения данного раствора полностью аналогичен предыдущему.
В подборке фото ниже представлены результаты химического серебрения монеты номиналом 50 копеек. Монета изготовлена из стали с латунным гальванопокрытием [8].
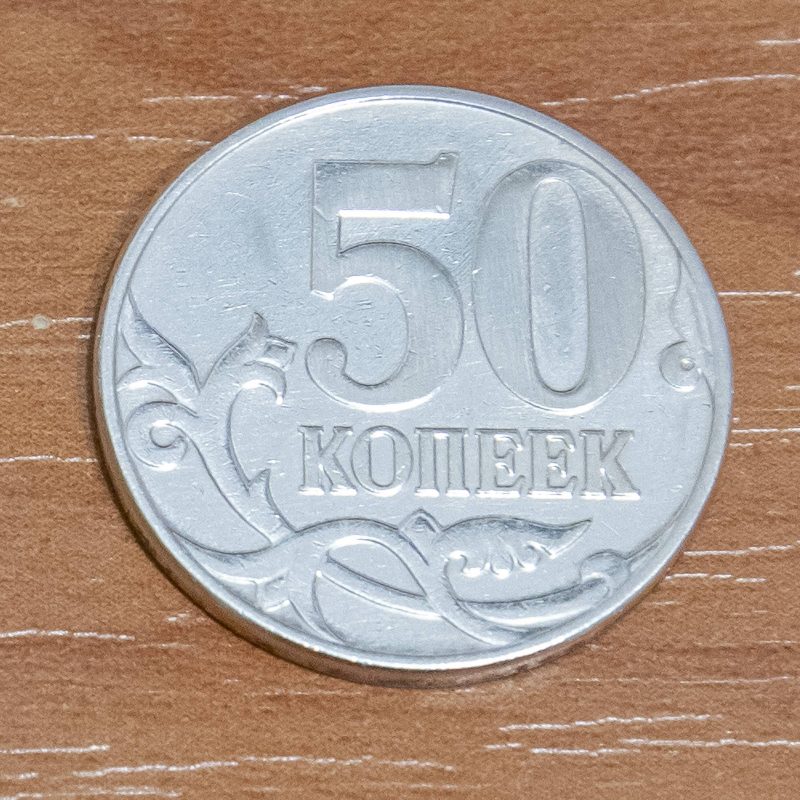

По фото хорошо видно, что покрытие получилось равномерным, мелкие детали проработались хорошо, что подтверждает возможность использования данного состава для финишного покрытия печатных плат с небольшой шириной дорожек.
В подборке фото ниже представлены результаты химического серебрения заготовки из фольгированного стеклотекстолита размером около 6 на 5 сантиметров составом №2 (левое фото) и сравнение результатов, полученных для обоих описанных составов (правое фото).


По фото хорошо видно, что на больших площадях покрытие так же получилось равномерным, без пятен и разводов. Это подтверждает возможность использования данного состава для химического серебрения печатных плат.
При проведении серебрения вторым раствором обратил внимание на интересный момент. После подготовки поверхности монеты поместил её в раствор серебрения. Ожидая окончания серебрения покачивал ванну для обеспечения циркуляции раствора. Слой серебра изначально стал равномерным, а потом начал понемногу краснеть. Возникло 2 предположения: либо поверх серебра вторым слоем осаживается ушедшая ранее в раствор медь, либо пошёл обратный процесс…
Вытаскиваю из раствора монету, промываю порошковым чистящим средством типа Сорти (Пемолюкс) при помощи ХБ ткани — под низом блестящий, практически белый слой. Снова возникает 2 предположения: либо это серебро, либо подслой никеля, как вариант (до этого я ещё не уточнил каким образом была нанесена латунь на монету поверх стали).
Беру наждачную бумагу, зашкуриваю белый слой в районе цифры «0», обезжириваю, снова помещаю монету в раствор серебрения. Дожидаюсь появления красноватого оттенка, достаю монету, снова промываю порошковым чистящим средством — под низом белый слой.
Таким образом изначально всё же осело серебро как и положено, а потом начала осаживаться поверх ушедшая в раствор медь. И хорошо, что осаживается она достаточно рыхлым слоем. В противном случае в таком растворе пришлось бы относительно точно контролировать время выдержки заготовки, а также циркуляцию электролита. Про эту особенность необходимо помнить при использовании данного раствора серебрения.
К сожалению, несмотря на простоту нанесения покрытий, а так же стойкость самого серебра к окислению данные покрытия всё же обладают рядом недостатков.
Во-первых, несмотря на стойкость самого серебра к окислению кислородом воздуха хранить готовые печатные платы необходимо в вакуумной упаковке с влагопоглотителем (если планируется долгое хранение). Как уже отмечалось выше, во влажной среде серебро тускнеет из-за образования на поверхности сульфида серебра (в воздухе всегда присутствует небольшое количество соединений серы. Особенно в городских условиях). При этом сам сульфид серебра достаточно инертен, что создаёт определённые проблемы при лужении даже с использованием некоторых активных флюсов.
Во-вторых, при нанесении паяльной маски после химического серебрения на участках, не защищённых маской, серебро склонно образовывать интерметаллиды (и в принципе склонно образовывать интерметаллиды). Это может приводить к практически полному отсутствию слоя металлического серебра на контактных площадках. Кроме того поверх площадок может образовываться тонкая плёнка, состоящая из оксида меди и сульфида серебра. Решение подобной проблемы полностью аналогично случаю окисления олова и сплава олово-висмут и подробно описано в соответствующей статье [9]. В заводских же условиях для решения данной проблемы наносят дополнительные подслои (например, подслой никеля) [5, 6]. Возможно о нанесении таких комбинированных покрытий и некоторых сплавов серебра мы поговорим в будущем в отдельной части статьи.
В-третьих, более качественное покрытие можно получить из электролитов с использованием циан-ионов. Но данные электролиты непригодны для использования в домашних условиях из-за высокой токсичности цианистого натрия (цианистого калия), а так же возможности образования циановодорода при использовании красной кровяной соли (гексацианоферрата (III) калия).
В-четвёртых, в домашних условиях возможно использование двухкомпонентных электролитов. Первый раствор обычно содержит аммиачный или цианидный комплекс серебра. Второй раствор содержит восстановитель. В качестве восстановителя применяют глюкозу (либо инвертный сахар), сегнетову соль, формалин и пр. Основным недостатком подобных составов является невозможность длительного хранения готового раствора. По отдельности растворы можно хранить длительное время, но после смешивания основного раствора и восстановителя готовый раствор необходимо использовать в течение суток. Таким образом подобные составы также малопригодны для домашнего применения.
Таким образом обсуждение процесса химического серебрения в домашних условиях подходит к концу и мы переходим к обсуждению химического лужения.
За более чем год экспериментов самым стабильным из всех ранее описанных составов, оказался состав номер 1 (с молочнокислым натрием). Небольшой выпавший осадок образовался из-за не особо чистых реактивов. Никакого другого осадка при хранении не было и нет до сих пор, несмотря на прошедший ощутимый промежуток времени [1].
Из обнаруженных недостатков — необходимо при приготовлении раствора следить за его pH — он должен быть в районе 2 — 2.5. Впрочем, это касается вообще всех описанных составов химического лужения — итоговый pH должен быть в районе 2-2.5. Для корректировки pH в растворы добавляется дополнительное количество кислоты.
Другой обнаруженный недостаток (точнее особенность приготовления раствора) — при приготовлении раствора главное его не перегреть. При перегреве, несмотря на большой избыток тиомочевины олово в растворе способно окисляться (а комплексы распадаться с выпадением серы в осадок) — вместо желтоватого раствора получится тёмный коричнево-серый раствор, часто с хлопьями. Такой раствор для работы не пригоден. При приготовлении состава номер 1 достаточно на водяной бане нагревать до температуры 40-45 градусов Цельсия (температура 50-60 градусов Цельсия уже излишняя). При этом хлорид олова необходимо присыпать небольшими порциями, интенсивно и тщательно перемешивая раствор до полного растворения уже добавленной порции.
При изготовлении печатных плат я в основном пользуюсь именно первым составом химического лужения.
В подборке фото ниже показана заготовка, залуженная раствором номер 1, более чем через год после его приготовления.


По фото хорошо видно, что раствор хорошо без каких-либо проблем и дефектов лудит заготовки, что подтверждает хорошую сохраняемость раствора с данным составом.
Продолжая эксперименты с растворами лужения обнаружил ошибку в рецептурах с добавлением нитрата висмута при осаждении сплава олово-висмут.
В оригинальной рецептуре указано: «Улучшить паяемость и срок хранения описанных составов можно добавлением 5-7 г/л нитрата висмута. Подобная добавка позволяет осаживать из раствора сплав олово-висмут с содержанием висмута до 1.5-2%».
Это утверждение не соответствует действительности. В реальности необходимо приготовить раствор нитрата висмута с концентрацией 50 г/л. Раствор необходимо готовить в кислой среде т.к. в воде нитрат висмута не растворим и гидролизуется. Я брал 100 мл 47% азотной кислоты на литр раствора (необходимо использовать наименьшее возможное количество азотной кислоты).
После этого необходимо в раствор лужения добавить 2-6 мл. полученного раствора. Максимально рекомендуемая концентрация нитрата висмута в конечном растворе не должна превышать 0.2-0.3 г/л (рекомендуемая концентрация 0.1 г/л), что минимум в 20 раз меньше.
Теперь-то не удивительно почему у меня с исходными концентрациями не получалось осадить сплав олово-висмут (олово окислялось, а висмут выпадал тёмным рыхлым слоем — такой эффект заметен при концентрации нитрата висмута от 0.3 г/л и выше. При концентрации 0.3 г/л примерно через 3-5 минут нахождения в растворе заготовка начинает ощутимо темнеть. Если в этот момент её извлечь, хорошо промыть водой, а потом порошковым чистящим средством, то паяемость покрытия сохранится на хорошем уровне. В противном же случае покрытие придётся удалить и повторить процесс нанесения заново. Именно по этой причине граница в 0.3 г/л нитрата висмута условно является верхней границей допустимой концентрации, а рекомендуемая концентрация 0.1 г/л). После корректировки концентраций процесс осаждения сплава пошел нормально [10, 11].
Если же у вас есть точные весы, то нитрат висмута лучше в нужной навеске (0.1 г/л) сразу добавлять в исходный раствор лужения.
В подборке фото ниже представлена заготовка, залуженная составом номер 1 с добавлением 0.1 г/л нитрата висмута (левое фото), а так же сравнение заготовок с и без нитрата висмута (правое фото).


По фото хорошо видно, что процесс химического лужения с нитратом висмута протекает нормально при указанных выше концентрациях.
Описанный ранее раствор номер 2 неплох для использования условно здесь и сейчас. Хранится он ощутимо хуже по сравнению с раствором номер 1. Уже через 2-3 месяца на дне выпадет ощутимый осадок (т.к. раствор достаточно активно поглощает кислород из воздуха). В общем-то, если готовить понемногу (на 2-3 месяца) и использовать регулярно — вполне удобен и пригоден для работы.
Раствор номер 3 в целом неплох, но основной минус — каждый раз при использовании его необходимо нагревать на водяной бане до полного растворения осадка. По этой же причине в такой раствор проблематично добавлять нитрат висмута т.к. его концентрация в растворе будет не стабильной.
Раствор номер 4 несколько труден в приготовлении т.к. необходимо подобрать оптимальную концентрацию гипофосфита натрия. Гипофосфит натрия достаточно сильный восстановитель. Если его будет слишком много — выпадет осадок. Если же слишком мало — будет храниться не особо хорошо (примерно как второй раствор).
Таким образом, подводя итог по описанным ранее растворам химического лужения, в общем и целом я рекомендую использовать растворы номер 1 и номер 2. Для длительного хранения — раствор номер 1, а для использования здесь и сейчас — раствор номер 2.
Кроме хлорида олова во всех описанных рецептурах можно использовать и другую растворимую соль олова — сульфат олова (II). При этом концентрации всех реактивов можно оставить теми же самыми. В реальности использовать сульфат олова даже проще т.к. он хуже поддаётся гидролизу. Тем не менее небольшое наличие хлорид-ионов в растворе химического лужения благоприятно сказывается на качестве получения итоговых покрытий. Поэтому оптимальным может быть использование смеси, состоящей из 50% хлорида олова и 50% сульфата олова по массе.
Таким образом раствор №1 будет выглядеть следующим образом:
- Двухлористое олово — 10 г/л;
- Сульфат олова (II) — 10 г/л;
- Тиомочевина — 70 г/л;
- Серная кислота — 120 мл. 30% раствора;
- Натрий молочнокислый — 150 г/л;
- Вода дистиллированная — до 1 л.
А раствор №2 будет выглядеть следующим образом:
- Двухлористое олово — 10 г/л;
- Сульфат олова (II) — 10 г/л;
- Тиомочевина — 40 г/л;
- Серная кислота — 120 мл. 30% раствора;
- Гидроксид натрия — 6 г/л;
- Вода дистиллированная — до 1 л.
При этом в оба раствора при необходимости можно добавлять нитрат висмута для осаждения сплава олово-висмут.
В подборке фото ниже показана заготовка, залуженная комбинированным раствором номер 2 с добавлением 0.1 г/л нитрата висмута.
Следует отметить, что даже такое небольшое добавление нитрата висмута окрашивает растворы лужения в насыщенный соломенно-жёлтый цвет.



По фото хорошо видно, что процесс химического лужения с добавлением нитрата висмута протекает нормально при указанных выше концентрациях. Описанный раствор хорошо и без каких-либо проблем и дефектов лудит заготовки.
В подборке фото ниже показана заготовка, залуженная комбинированным раствором номер 2 без добавления нитрата висмута, а так же сравнение качества лужения без добавления нитрата висмута (левое фото и левая заготовка) и с нитратом висмута (правая заготовка).


И в заключении следует отметить, что для химического лужения можно использовать раствор серебрения №1, описанный в начале данной статьи, но с заменой нитрата серебра на хлорид олова, сульфат олова, либо же их комбинацию в соотношении 50/50 по массе. При этом к таким растворам можно добавлять нитрат висмута для осаждения сплава олово-висмут. Если вы внимательно читали предыдущую часть статьи, посвящённой химическому лужению, то могли заметить, что состав практически идентичен раствору номер 3. Отличие только в том, что в данном растворе используется лимонная кислота вместо винной и в более высокой концентрации. Такой раствор оказался ощутимо стабильнее, чем описанный ранее.
В подборке фото ниже представлена заготовка, залуженная в таком комбинированном составе химического лужения с добавлением 0.1 г/л нитрата висмута.


Приготовление раствора лужения по рецептуре №1 с заменой нитрата висмута на смесь хлорида и сульфата олова в соотношении 1:1 представлено на видео ниже.
Единственное что следует отметить по процессу приготовления дополнительно: при приготовлении раствор может приобретать небольшой желтоватый оттенок. Чуть заметный оттенок — это нормальное явление при сохранении прозрачности раствора.
Кроме того, может наблюдаться незначительное помутнение раствора с опалесценцией и дальнейшим выпадением небольшого количества желто-коричневого осадка. Наиболее вероятная причина такого осадка — загрязнение используемых реактивов солями железа (что, кстати, и наблюдается на приведённом выше видео в самом конце).
В случае последнего необходимо перелить раствор в герметичную тару и дать отстояться без доступа воздуха несколько дней (либо профильтровать через плотный фильтр). После этого необходимо слить отстоявшийся прозрачный раствор. Необходимо хранить раствор в плотно упакованной таре без доступа воздуха.
Отсюда следует очевидный вывод — используйте для приготовления растворов лужения и серебрения реактивы, имеющие соответствующую квалификацию (не хуже ХЧ), а также дистиллированную воду!
Выпадение же белого, нерастворимого при длительном перемешивании осадка говорит о том, что происходит гидролиз добавляемых солей олова т.е. слишком большой скорости их добавления. В такой ситуации необходимо уменьшить добавляемые порции и не добавлять каждую следующую до полного растворения предыдущей.
А на этом на сегодня всё. С уважением, Андрей Савченко.
P.S.
В целом изготовление печатных плат в домашних условиях содержит множество моментов, где необходимо просто дождаться окончания того или иного технологического процесса. Например, при химическом лужении (серебрении) необходимо 10-20 минут ожидать окончания процесса для каждой заготовки. Время ожидания можно занять различными интересными экспериментами. Сегодня мы попробуем понаблюдать за флуоресценцией различных веществ.
В подборке фото ниже показана флуоресценция родамина 6G (родамина Ж) в 20% водном растворе ДМСО (в 100% флуоресценция была бы ещё ярче). Для наблюдения за процессом необходимо приготовить 20% раствор ДМСО, взять небольшое количество родамина Ж или родамина С (В) на кончике ножа, засыпать в раствор ДМСО и включить УФ-подсветку. Стоит отметить, что в проходящем и отражённом свете получается несколько разная картина.
Работать с родаминами необходимо осторожно, используя перчатки и подложку из полиэтилена (либо подобного материала) т.к. они обладают хорошими красящими свойствами (т.е. достаточно маркие и плохо отмываются — не зря родамин С (В) используют в качестве красителя для химических ловушек, а так же метят деньги для «взяток» при оперативно-розыскных мероприятиях) [12, 13, 18].






В живую данный процесс выглядит вот так:
Из ингредиентов, доступных в домашних условиях, отчётливой флуоресценцией обладает куркумин. Куркумин активно используется в кулинарии в качестве пищевого красителя и зарегистрирован в виде пищевой добавки под номером Е100.
Во-первых, куркумин является индикатором pH: в нейтральной среде он жёлто-оранжевый, в щелочной среде — красно-бурый. Во-вторых, куркумин при освещении УФ даёт яркую желто-зелёную флуоресценцию.
В качестве источника куркумина можно воспользоваться спиртовой вытяжкой куркумы. Для этого необходимо взять 20-30 грамм куркумы, залить 100-150 мл. этилового (изопропилового) спирта, тщательно взболтать и дать постоять 1-2 часа. После этого останется только отфильтровать полученную вытяжку. В готовой вытяжке будут присутствовать и другие куркуминоиды, но основным будет именно куркумин. Работать с куркумином необходимо осторожно, используя перчатки и подложку из полиэтилена (либо подобного материала) т.к. он обладает хорошими красящими свойствами (т.е. достаточно маркий и плохо отмывается) [14, 17].
В подборке фото ниже наглядно показана флуоресценция вытяжки из куркумы. На фото с двумя растворами вытяжки концентрация отличается примерно в 10 раз.







В живую это выглядит вот так:
Ещё одним доступным красителем, флуоресценцию которого можно понаблюдать в домашних условиях, является флуоресцеин (и его динатриевая соль — Уранин А). Сам по себе флуоресцеин плохо растворим в воде. Значительно лучше растворима его динатриевая соль — уранин А. Поэтому первый обычно растворяют в слабом растворе гидроксида натрия. Если растворять флуоресцеин в слабом растворе гидроксида натрия, то фактически будет образовываться та самая хорошо растворимая динатриевая соль и уже она будет растворяться в воде и давать яркую флуоресценцию. Сам же уранин А можно сразу растворять в обычной воде без дополнительной подготовки [15, 16].
Для наблюдения за процессом необходимо приготовить 1-3% раствор гидроксида натрия, взять небольшое количество флуоресцеина на кончике ножа, засыпать в раствор и включить УФ-подсветку. При использовании уранина А его небольшое количество на кончике ножа сразу засыпается в тёплую воду и включается УФ-подсветка.
В подборке фото ниже наглядно показана флуоресценция флуоресцеина (уранина А).





В живую это выглядит вот так:
В первой части статьи, посвящённой химическому лужению я рассказывал про эксперимент с хемилюминесценцией люминола. Если же повторить такой эксперимент, но в раствор предварительно добавить небольшое количество флуоресцеина (уранина А), то световая энергия, выделяющаяся при хемилюминесценции будет преобразована во флуоресценцию красителя, что показано в подборке фото ниже.


А если увеличить концентрацию реагентов в несколько раз, взять побольше растворителя (воды) и повторить процесс, то эксперимент будет выглядеть значительно эффектнее (см. подборку фото ниже).


Список использованной литературы:
- Химическое лужение
- Халилов И.Х. Гальванотехника для ювелиров: практ. пособие.-Саратов: изд-во Сарат. ун-та., 2003, 60 с.
- Химическое осаждение металлов из водных растворов.- под ред. В. В. Свиридова.— Мн.: изд-во «Университетское», 1987.— 270 с.
- Федотьев Н.П., Бибиков Н.Н., Вячеславов П.М, Грилихес С.Я. «Электролитические сплавы». – М.-Л: Машгиз, 1962. – 312 с.
- Иммерсионные финишные покрытия под пайку, «Монтаж компонентов», Аркадий Медведев, Светлана Шкундина
- Современный финишный процесс иммерсионного серебрения YMT GALAXY, журнал «Вектор высоких технологий», №3 (38), 2018 год, Дмитрий Костенников, Аркадий Сержантов, Светлана Шкундина
- Монета Банка России номиналом 10 рублей
- Монета номиналом 50 копеек
- Нанесение паяльной маски
- Химическое осаждение олова
- Иммерсионные покрытия
- Диметилсульфоксид (ДМСО)
- Гордон П., Грегори П. Органическая химия красителей: перевод с английского. — Москва: Мир, 1987 г.
- Куркумин
- Флуоресцеин
- Флуоресцеин, часть 1 — часть 7, В.Н. Витер, Химия и химики, №6, 2011 год
- Эксперименты с куркумином, Химия и химики, №2, 2021 год
- Родамин Б и лазер, Химия и химики, №6, 2011 год