Атомно-эмиссионная спектроскопия (АЭС)
Добрый день, уважаемые читатели. Сегодня мы кратко поговорим об атомно-эмиссионной спектроскопии и её применении в аналитической химии.
Итак, атомно-спектральный анализ — это разновидность анализа вещества, основанная на измерении интенсивности электромагнитного излучения, испускаемого или поглощаемого атомами определяемого элемента, которые находятся в газо- или парообразном состоянии.
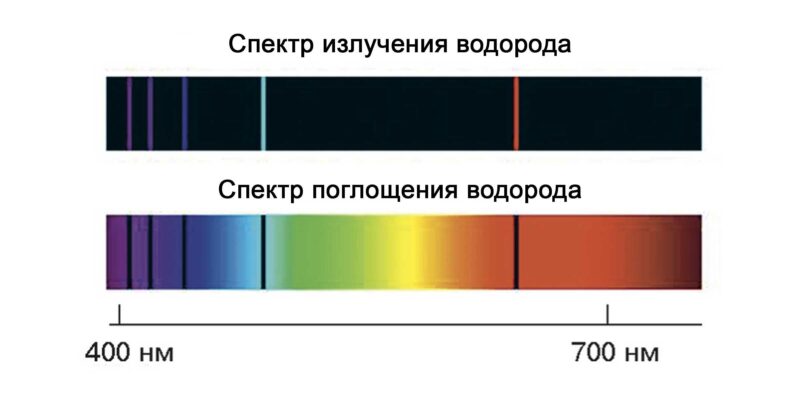
В зависимости от типа регистрируемых спектров (спектральных линий) можно выделить 2 основные разновидности атомно-спектрального анализа: эмиссионный (регистрируются спектры излучения) и абсорбционный (регистрируются спектры поглощения).
На рисунке ниже представлен пример оптического эмиссионного спектра (спектра излучения) и оптического абсорбционного спектра (спектра поглощения) водорода.
Таким образом, атомно-эмиссионная спектроскопия (АЭС) — это разновидность анализа вещества, основанная на термическом возбуждении атомов или ионов, которые находятся в паро- или газообразном состоянии, и регистрации оптических спектров (качественный анализ) или измерении интенсивности отдельных спектральных линий определяемых элементов (количественный анализ).
Суть АЭС заключается в том, что под действием энергии возбуждения атом исследуемого вещества переходит в возбужденное состояние. Обратный переход сопровождается излучением фотона с определённой частотой (длиной волны).
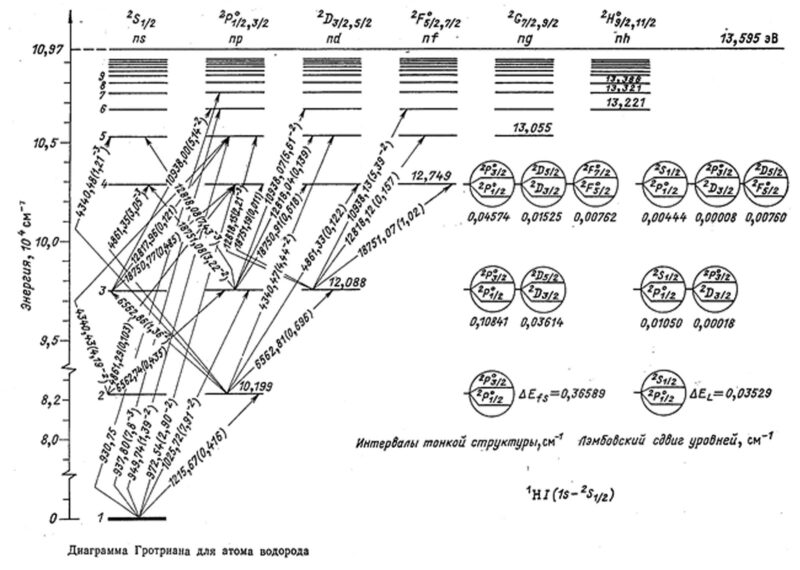
Число всех переходов и, следовательно, число линий в спектре элемента определяется числом и размещением внешних электронов атома. Электронную структуру атома и совокупность всех разрешённых переходов можно представить при этом графически в виде диаграммы Гротриана.
Спектры атомов с малым числом валентных электронов (как, например, в случае щелочных металлов) имеют относительно мало линий. Атомы же со сложно построенными внешними оболочками – дают спектры с достаточно большим числом линий. Линии, обусловленные переходом электрона на основной уровень, принято называть резонансными.
Важное значение в аналитической химии имеют все резонансные линии, соответствующие переходам с первого возбужденного уровня. Это связано с тем, что данные линии имеют высокую интенсивность, обеспечивающую большую чувствительность — поэтому именно их наиболее часто и используют для аналитических целей.
Для возбуждения резонансных линий в спектрах щелочных металлов необходима незначительная энергия, в то время как в случае неметаллов эта энергия значительно выше. При этом резонансная линия смещается из видимой части спектра в ультрафиолетовую область… В связи с этим основная область применения АЭС – определение щелочных и щелочноземельных элементов.
В качестве источника возбуждения в АЭС используется пламя горелки, дуговой разряд постоянного тока, низковольтный дуговой разряд переменного тока, высоковольтный искровой разряд, аргоновая плазма и пр.
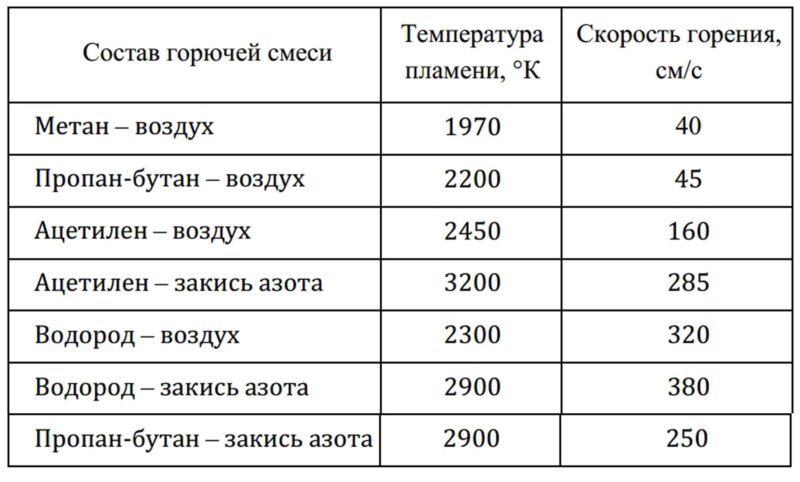
Типовые составы горючих смесей при использовании горелки в качестве источника возбуждения представлены на рисунке ниже.
Так же следует отметить, что процесс атомизации в пламени горелки имеет достаточно сложную природу и подвержен ряду физико-химических помех. Из-за небольшого времени пребывания частиц исследуемого вещества в высокотемпературной зоне пламени необходимо, что бы процесс атомизации протекал быстро.
При попадании в пламя частицы аэрозоля быстро теряют растворитель, превращаясь в твердые частицы, которые содержат все растворенные в анализируемом растворе вещества. На следующей стадии происходит испарение твёрдых частиц с одновременным разложением — образуются раскалённые пары свободного металла (атомизация), атомы переходят в возбуждённое состояние и при обратном переходе излучают фотоны.
Одной из помех атомизации является образование оксидов элементов, проявляющих высокое сродство к кислороду. Например, кальций в пламени метан–воздух или пропан-бутан–воздух преимущественно находится в виде оксида, поэтому определение этого элемента проводят не по атомной, а по молекулярной эмиссионной линии.
Полученный аналитический сигнал (спектр излучения, а так же интенсивность спектральных линий) анализируется при помощи специализированной аппаратуры и на основании анализа делается вывод о качественном и количественном составе образца.
В лабораторной практике для первичной качественной идентификации некоторых элементов также применяется достаточно сильно упрощённый вариант АЭС: в таком варианте производится наблюдение наиболее интенсивных резонансных спектральных линий визуально. Всем нам он знаком как метод идентификации по окрашиванию пламени горелки.
Давайте проведём несколько практических опытов такой идентификации и попробуем сравнить полученный результат с эмиссионными спектрами исследуемых элементов.
1. Для проведения первого опыта необходимо взять небольшое количество сульфата меди и внести в пламя горелки — пламя окрасится в изумрудно-зелёный цвет. В качестве основания для внесения можно воспользоваться вольфрамовым электродом. Для этого его предварительно разогревают над пламенем горелки, затем окунают в соль меди и вновь вносят в пламя горелки. Вольфрам удобен прежде всего своей тугоплавкостью и химической стойкостью. Если в качестве соли меди использовать хлорид, то пламя будет иметь сине-зелёный цвет.
Опыт можно провести и немного иначе. Для этого необходимо кусочек медной проволоки смочить соляной либо серной кислотой, а потом внести в пламя горелки. При взаимодействии с кислотой на поверхности меди образуются соответствующие соли.
Вживую это выглядит вот так:
Эмиссионный спектр меди показан на рисунке ниже (интенсивность спектральных линий показана условно).
2. Для проведения второго опыта необходимо взять небольшое количество хлорида стронция (0.5-1 г) и поместить в негорящую тару. Далее необходимо добавить 5-7 мл этилового спирта и тщательно перемешать до однородной массы. Если теперь поджечь полученную массу, то можно заметить, что пламя окрасилось в карминово-красный цвет.
Вживую это выглядит вот так:
Эмиссионный спектр стронция показан на рисунке ниже (интенсивность спектральных линий показана условно).
3. Для проведения третьего опыта необходимо взять небольшое количество йодида цезия (0.5-1 г) и поместить в негорящую тару. Далее необходимо добавить 5-7 мл этилового спирта и тщательно перемешать до однородной массы. Если теперь поджечь полученную массу, то можно заметить, что пламя окрасилось в розово-фиолетовый цвет.
Вживую это выглядит вот так:
Эмиссионный спектр цезия показан на рисунке ниже (интенсивность спектральных линий показана условно).
4. Для проведения четвёртого опыта необходимо взять небольшое количество хлорида кальция (0.5-1 г) и поместить в негорящую тару. Далее необходимо добавить 5-7 мл этилового спирта и тщательно перемешать до однородной массы. Если теперь поджечь полученную массу, то можно заметить, что пламя окрасилось в кирпично-красный (оранжево-красный) цвет.
Вживую это выглядит вот так:
Эмиссионный спектр кальция показан на рисунке ниже (интенсивность спектральных линий показана условно). Сравните его с эмиссионным спектром стронция, показанным чуть ранее.
5. Для проведения пятого опыта необходимо взять небольшое количество хлорида калия (0.5-1 г) и поместить в негорящую тару. Далее необходимо добавить 5-7 мл этилового спирта и тщательно перемешать до однородной массы. Если теперь поджечь полученную массу, то можно заметить, что пламя окрасилось в розово-фиолетовый цвет.
Вживую это выглядит вот так:
Эмиссионный спектр калия показан на рисунке ниже (интенсивность спектральных линий показана условно). Сравните его с эмиссионным спектром цезия, показанным чуть ранее.
6. Для проведения шестого опыта необходимо взять небольшое количество борной кислоты (5-10 г) и поместить в негорящую тару. Далее необходимо пропитать борную кислоту этиловым спиртом так, что бы получилась влажная кашица. Если теперь поджечь полученную массу, то можно заметить, что пламя окрасилось в зелёный цвет.
Вживую это выглядит вот так:
Эмиссионный спектр бора показан на рисунке ниже (интенсивность спектральных линий показана условно). Сравните его с эмиссионным спектром меди, показанным чуть ранее.
7. Для проведения седьмого опыта необходимо взять небольшое количество хлорида натрия (0.5-1 г) и поместить в негорящую тару. Далее необходимо добавить 5-7 мл этилового спирта и тщательно перемешать до однородной массы. Если теперь поджечь полученную массу, то можно заметить, что пламя окрасилось в насыщенный жёлтый цвет.
Вживую это выглядит вот так:
Эмиссионный спектр натрия показан на рисунке ниже (интенсивность спектральных линий показана условно).
8. Ну и напоследок приведём горение чистого этилового спирта. Для проведения опыта необходимо взять 5-7 мл 70% раствора этанола и налить в негорящую тару. После этого его необходимо аккуратно поджечь. Этанол горит голубоватым слабо светящимся пламенем.
Вживую это выглядит вот так:
Подводя итоги эксперимента можно заключить, что связь между эмиссионными спектрами различных элементов и цветом, в который они окрашивают пламя вполне однозначна и очевидна. Думаю демонстрационные опыты получились достаточно наглядными.
Вот такая она атомно-эмиссионная спектроскопия (АЭС)…
А на этом на сегодня всё. Спасибо, что дочитали до конца!
Список использованной литературы:
1. Атомно-эмиссионная спектроскопия (АЭС)
2. Основы аналитической химии. В 2 т. Т. 1 : учеб. для студ. учреждений высш. проф. образования / [Т. А. Большова и др.] ; под ред. Ю. А. Золотова. — 5-е изд., стер. — М. : Издательский центр «Академия», 2012. — 384 с.
3. Основы аналитической химии. В 2 т. Т. 2 : учеб. для студ. учреждений высш. проф. образования / [Н. В. Алов и др.] ; под ред. Ю. А. Золотова. — 5-е изд., стер. — М. : Издательский центр «Академия», 2012. — 416 с.
4. Сигеев А.С. Курс аналитической химии. Методическое пособие. – М: ООО «Луч», 2021.– 304 с.