Качественная идентификация белков
Добрый день, уважаемые читатели. Сегодня мы кратко поговорим о белках и их качественной идентификации.
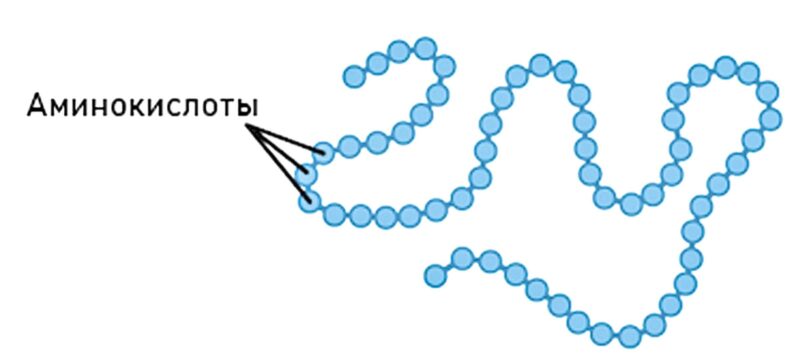
Итак, белки (протеины, полипептиды) – это высокомолекулярные органические соединения, состоящие из остатков аминокислот, связанных друг с другом при помощи пептидных связей. Обычно в состав белков входят 18–20 различных аминокислот. Все аминокислоты, входящие в состав белков, являются α-аминокислотами. Это связано с тем, что только аминогруппа, стоящая в α-положении, способна образовывать пептидную связь.
В структуре белка различают первичную, вторичную, третичную и четвертичную структуры.
Первичная структура — последовательность аминокислотных остатков в полипептидной цепи.
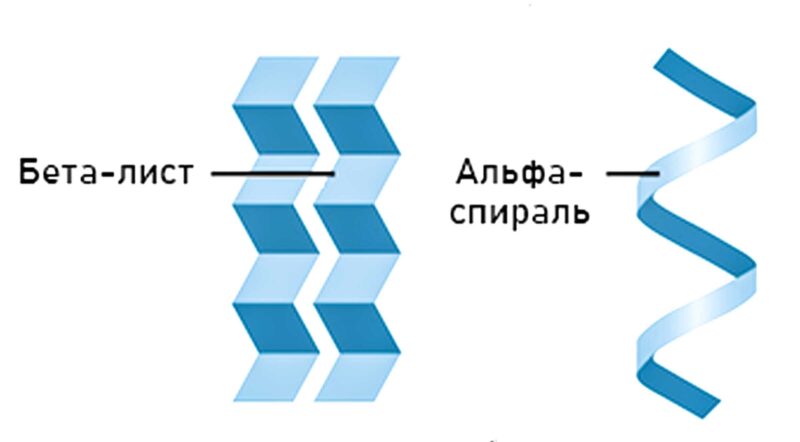
Вторичная структура — это локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Самыми распространёнными типами вторичной структуры являются α-спирали и β-листы (β-складки). α-спирали — это плотные витки вокруг длинной оси молекулы. β-листы (β-складки) — это несколько зигзагообразных цепей, в которых водородные связи образуются между удалёнными друг от друга аминокислотами в первичной структуре или разными цепями белка.
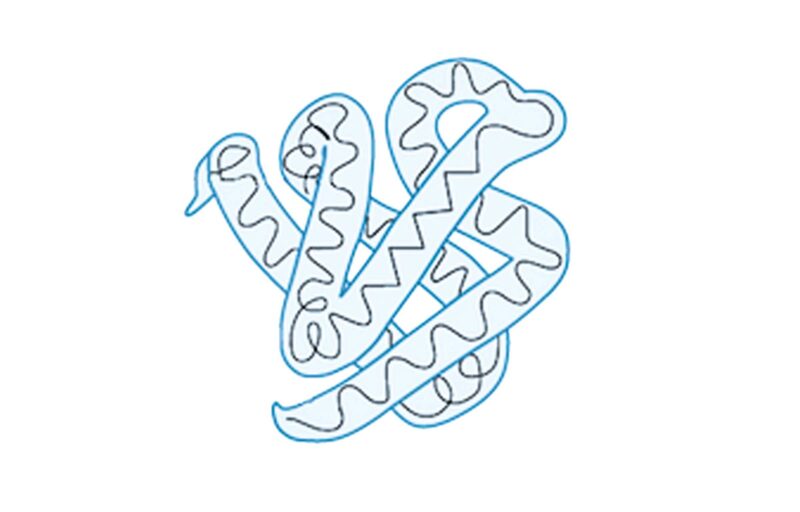
Третичная структура — это пространственное строение полипептидной цепи. Третичная структура состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий: ковалентными связями (например, дисульфидными мостиками), ионными связями, водородными связями, гидрофобным взаимодействием.
Четвертичная структура — это взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Для обнаружения белков используется ряд качественных реакций.
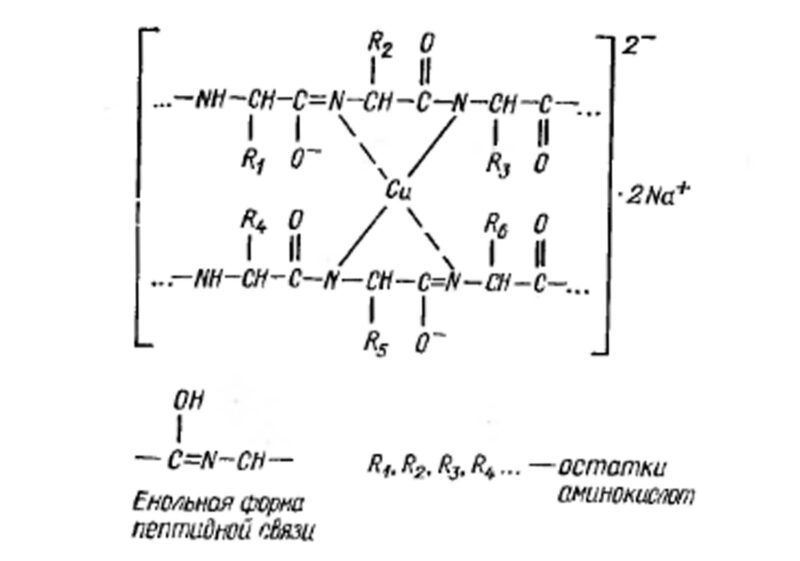
1. Наиболее широко известной реакцией является биуретовая реакция. Биуретовая реакция направлена на открытие полипептидной связи в белке. В реакцию вступают все пептиды, имеющие минимум две пептидные связи. При этом цвет образующегося комплекса зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий.
Для проведения опыта необходимо приготовить 80-100 мл 5% раствора гидроксида натрия. Далее в раствор добавляется 3-4 мл раствора яичного белка (для приготовления раствора необходимо белок одного куриного яйца растворить в 100 мл воды). Если теперь к такому раствору приливать понемногу 1-5% раствор сульфата меди (II) и тщательно перемешивать, то хорошо видно, что раствор сначала становится красно-фиолетового цвета, а потом окраска переходит в фиолетово-синюю.
Пептидные связи могут существовать в двух формах: кето-форме и енольной. В щелочной среде они переходят в енольную форму. При прибавлении ионов меди образуется биуретовый комплекс.
Вживую это выглядит во так:
Тем не менее биуретовую реакцию дают и некоторые небелковые вещества. Например, биурет, для которого данная реакция была проведена впервые и в честь которого получила своё название.
2. Другой известной реакцией является нингидриновая реакция. Нингидриновая реакция характерна для аминогрупп, находящихся в α-положении и входящих в состав белков, а также полипептидов и свободных аминокислот. При этом в случае с белками реакцию необходимо проводить в жёстких условиях — при кипячении с раствором нингидрина.
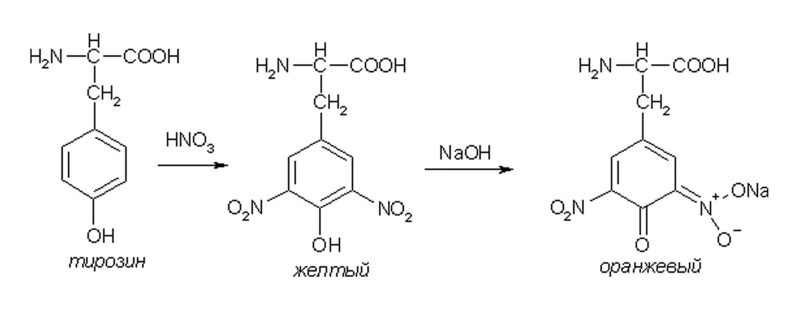
3. Ещё одной известной реакцией является ксантопротеиновая реакция (реакция Мульдера). Данная реакция положительна только в том случае, если в белке присутствуют ароматические аминокислоты (тирозин, фенилаланин, триптофан).
В результате реакции образуются нитропроизводные циклических аминокислот. При добавлении к раствору щелочи желтая окраска переходит в оранжевую, т.к. в щелочной среде нитропроизводные аминокислот образуют соли хиноидной структуры, имеющие жёлто-оранжевый цвет.
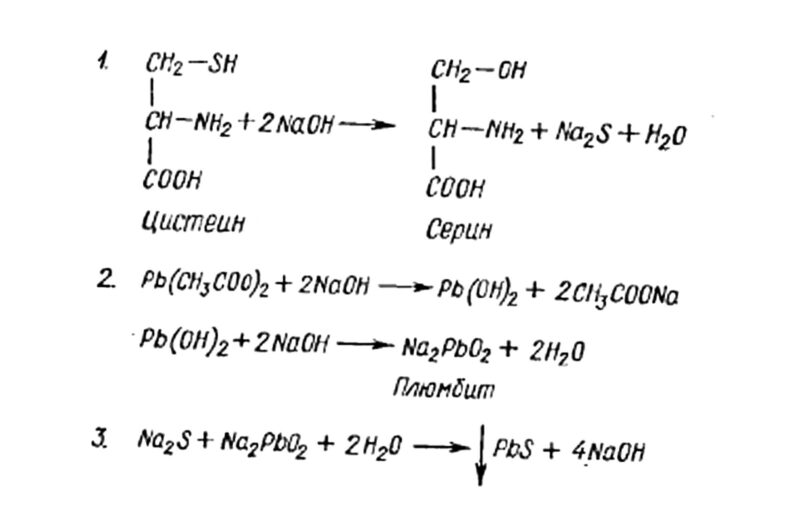
4. Серосодержащие аминокислоты можно обнаружить по сульфгидрильной реакции (реакция Фоля).
При проведении опыта предварительно проводят щелочной гидролиз белка. При гидролизе от белка отщепляется сульфидная группа, которую и обнаруживают по реакции Фоля: при взаимодействии плюмбита натрия с сульфидной группой образуется черный нерастворимый осадок сульфида свинца.
Приведённые выше реакции далеко не единственные, используемые в качественном анализе белков (пептидов и отдельных аминокислот). Существует ещё целый ряд специфических реакций, но эти наиболее известные и распространённые.
А на этом на сегодня всё. Спасибо, что дочитали до конца!
Список использованной литературы:
1. Качественная идентификация белков.
2. Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. В 3 томах. — М.: Мир, 1994.
3. Ленинджер А. Основы биохимии. В 3 томах. — М.: Мир, 1985.
4. Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание.
5. Химическая энциклопедия: в 5т./Гл.ред. И.Л. Кнунянц.—М.: Советская энциклопедия.